Прекрасные симметричные узоры ледяных кристаллов или твердая блестящая поверхность алмаза получаются из-за особого способа, каким соединены, или связаны, их атомы. От этих связей зависят свойства веществ и способы реагирования с другими веществами. 
Стабильные атомы не присоединяют и не теряют электроны со своей внешней электронной оболочки вокруг ядра атомов (см. «Строение атома»). Нестабильные атомы, чтобы обрести стабильность, соединяются с другими атомами. 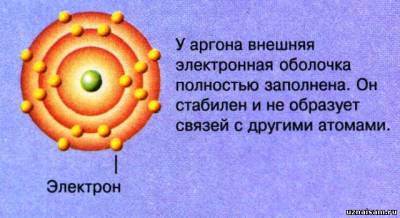
Большинство атомов имеют несколько электронных оболочек (уровней). На первом уровне могут разместиться 2 электрона, на втором и третьем — до 8. Однако некоторые атомы имеют и до 18 электронов на третьем уровне. Когда один уровень заполняется, электроны образуют новый уровень. Расположение электронов вокруг ядра атома называется электронной конфигурацией. Она записывается в виде чисел после названия атома. 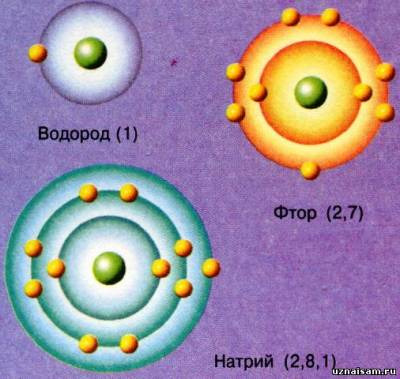
Для достижения стабильности внешней электронной оболочки атом может либо делить электроны с другим атомом, либо присоединять или отдавать электроны другому атому (см. «Ковалентные связи», «Ионные связи», «Связи в металлах»).
|