Электролиз — это метод разделения элементов в соединении путем пропускания электрического тока через расплав или раствор соединения. Этот процесс используется для выделения очень активных металлов из руд, а также для очистки металлов. Он также применяется, если нужно покрыть какой-либо объект тонким слоем металла. Такой процесс называется гальваностегия. Во время электролиза только ионные соединения могут проводить электрический ток. Это происходит потому, что частицы, из которых состоят ионные соединения, под названием ионы, имеют электрический заряд. Одни частицы, называемые анионами, имеют отрицательный заряд, а другие, катионы — положительный.
Ионное соединение в электролизе называется электролитом. Электрический ток проходит по электролиту через два электрода. Один электрод (анод) несет положительный заряд, другой (катод) — носитель отрицательного заряда. В качестве электролита может использоваться раствор хлорида меди (II). Он состоит из положительно заряженных катионов меди и отрицательно заряженных анионов хлора. 
Для того чтобы пропустить электрический ток через раствор, в него погружаются два электрода, которые подсоединяются к источнику тока. Но до того как в раствор поступит электрический ток, ничего не произойдет. 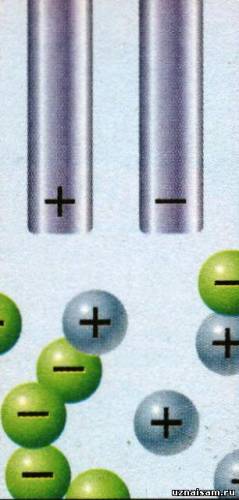
Как только начнется поступление тока, катионы притянутся к отрицательному электроду, где присоединят к себе электрон. Анионы же устремятся к положительному электроду, где потеряют по одному электрону. 
|